Pseudomonas aeruginosa
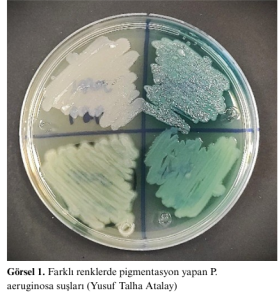
Pseudomonas aeruginosa, hem aerobik hem de fakültatif anaerobik koşullarda büyüyebilen, gram-negatif, yeşil tonlarında pigmentasyon yapabilen, çomak şeklinde bir bakteridir. Bu özelliği sayesinde toprakta, suda, bitkilerde ve insanlarda gelişebilmektedir. P. aeruginosa, yüksek tuz ve boya konsantrasyonları gibi zorlu fiziksel koşullarda ve geniş yelpazede antibiyotik içeren ortamlarda bile çoğalabilecek kadar minimal besin gereksinimine sahiptir [1-4].
Bu bakteri, çevresel koşullara bağlı olarak çeşitli karbon kaynaklarını kullanabilen pek çok gen ve düzenleyici ağları içeren, 5–7 Mb büyüklüğünde büyük ve karmaşık bir genoma sahiptir. P. aeruginosa, özellikle immün sistemi baskılanmış bireylerde (örneğin kistik fibrozis hastalarında) hayati tehlike oluşturan akut ve kronik enfeksiyonlara yol açabilmektedir [4,5].
P. aeruginosa en önemli hastane kaynaklı patojenlerden biri olup özellikle ciddi derecede hastalıklı bireylerde ve immün sistemi baskılanmış bireylerde hastane kaynaklı enfeksiyon nedenlerinin başında yer almaktadır. P. aeruginosa hastane kaynaklı kan dolaşımı enfeksiyonlarının %4,7-8,9’undan ve çoklu ilaca dirençli (MDR) P. aeruginosa bakteriyemisinin %26,3’ünden sorumlu olmakla birlikte ölüm oranları yaklaşık %30’dur [6-8].
Çeşitli çalışmalar P. aeruginosa’nın diğer patojenlerle karşılaştırıldığında daha ciddi enfeksiyonlara yol açtığını göstermiştir. Örneğin, Thaden ve ark. (2017) 13 yıllık retrospektif çalışmada bakteri türlerinin 2600’den fazla kan dolaşımı enfeksiyonu nedeniyle hastaneye yatışı gerçekleşen hastalar üzerindeki tedavi sonucu üzerine etkilerini incelemiş ve diğer bakteri türlerine kıyasla P. aeruginosa ile daha yüksek hastane içi ölüm ilişkisi saptamışlardır [9].
Antimikrobiyal Direnci
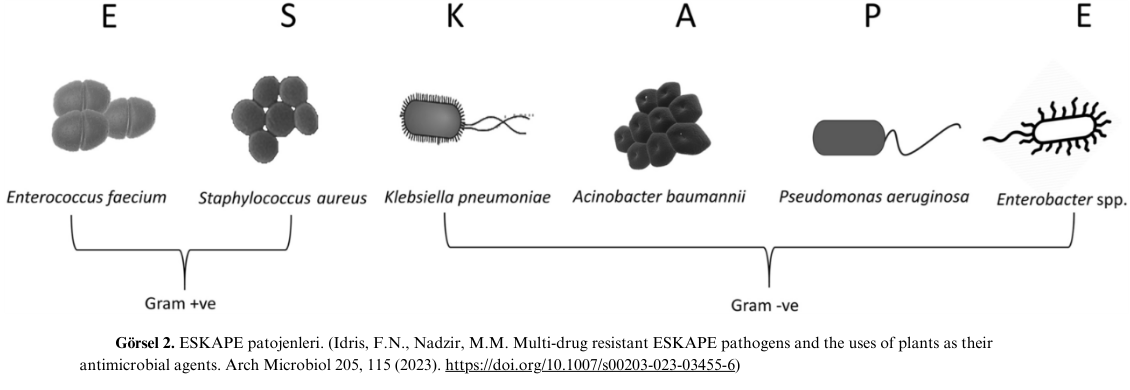
Antimikrobiyallere karşı artan direnç toplum sağlığı için oldukça büyük bir tehlike arz etmektedir. P. aeruginosa, ilaç direnci ilişkili ölümlerden sorumlu ilk 6 patojen arasında yer almaktadır ve ESKAPE patojenleri arasında listelenmiştir [10,11]. Ayrıca, DSÖ (WHO/World Health Organisation), karbapenem dirençli (CR/Carbapeneme resistant) P. aeruginosa‘yı acilen yeni antibiyotiklere ihtiyaç duyulan “kritik öncelikli” patojenler arasında listelemektedir [12].
Patojenik bakteriler, dış membranlarının sınırlı geçirgenliği, çoklu ilaç akış pompalarının varlığı, antibiyotik parçalayıcı enzimlerin ekspresyonu (ör. karbapenemazlar, β-laktamazlar), büyüme durumunun değişmesi (ör. biyofilm oluşumu), mutasyonlar ve/veya direnç genlerinin kazanılması gibi doğal özellikleri nedeniyle çeşitli antibiyotik türlerine karşı dirençli hale gelirler [13]. Antibiyotik direncindeki artan eğilim nedeniyle bakteriyel enfeksiyon kaynaklı ölümlerin kanser nedenli ölümleri geçeceği öngörülmektedir [14]. Bu durumun 2050’ye kadar sağlık bakım sistemlerinde 100 trilyon doları aşan mali yük getireceği düşünülmektedir [15]. Bunun yanında antibiyotik kullanımının büyükbaş/küçükbaş hayvancılık ve kümes hayvancılığı sektöründe artmasına bağlı olarak çevresel ve hayvansal patojenlerin antimikrobiyallere karşı direnci artmakta ve bu dirençli patojenler su, toprak, hayvansal ürünler, hayvanla temas gibi çeşitli yollarla insanlara geçebilmektedir [16,17].
Bakteri Metabolitleri
Çeşitli mikroorganizmalardan elde edilen 23000’den fazla ikincil metabolit, yeni antimikrobiyallerin geliştirilmesinde odak noktası haline gelmiştir [18,19]. İkincil metabolitler stres gibi spesifik koşullara cevap olarak birincil metabolitlerden sentezlenen moleküllerdir [20]. Antibakteriyel ikincil metabolitler molekül ağırlıklarına göre 2 ana gruba ayrılır: 1-Düşük molekül ağırlıklılar (ör. hidrojen peroksit, organik asitler), 2-Yüksek molekül ağırlıklılar (bakteriyosinler ve/veya bakteriyosin benzeri inhibitör maddeler (BLIS)) [21,22]. Ribozomlar tarafından üretilen bu hücre dışı toksinler, rakip suşları (ana mikroorganizmaya yakın olanlar) inhibe ederek veya öldürerek çalışır, sonuçta biyolojik yaşam alanını güvence altına alarak ve besin maddelerine erişimi iyileştirerek hayatta kalmayı artırır [23,24].
P. aeruginosa oldukça yaygın bir bakteriyel patojen olarak kabul edilmektedir. Bu fırsatçı gram-negatif gammaproteobakteri, yayılmasını kolaylaştırmaya hizmet eden bir dizi hücre dışı ürün üretme yeteneğine sahiptir [25]. P. aeruginosa suşlarının %90’ı en az bir tür bakteriyosin üretebildiğinden, protein bazlı antimikrobiyal araştırmaları için mükemmel bir modeldir [24].
Piyosin
1945 yılında Edwin Hays ve meslektaşları ilk olarak Pseudomonas pyocyanea‘dan elde edilen antibiyotik maddeleri tanımlamış ve 9 yıl sonra François Jacob bu antibiyotikleri “pyocines” olarak adlandırmıştır. Günümüzde “pyocin”ler, artık P. aeruginosa olarak bilinen P. pyocyanea tarafından üretilen dar spektrumlu bakteriyosinleri ifade etmektedir [26-28].
P. aeruginosa tarafından üretilen piyosinler, zamanla S-, L-, F- ve R-piyosinler olarak adlandırılan çeşitli tiplere ayrılmıştır. Bir P. aeruginosa suşu herhangi bir piyosin türü kombinasyonunu ya da tüm piyosin türlerini üretme yeteneğine sahip genetik faktörlere sahiptir. Her piyosin alt tipi; fiziksel ve kimyasal özellikleri, dışa aktarım mekanizmaları ve etki şekli bakımından farklılık gösterir [29].
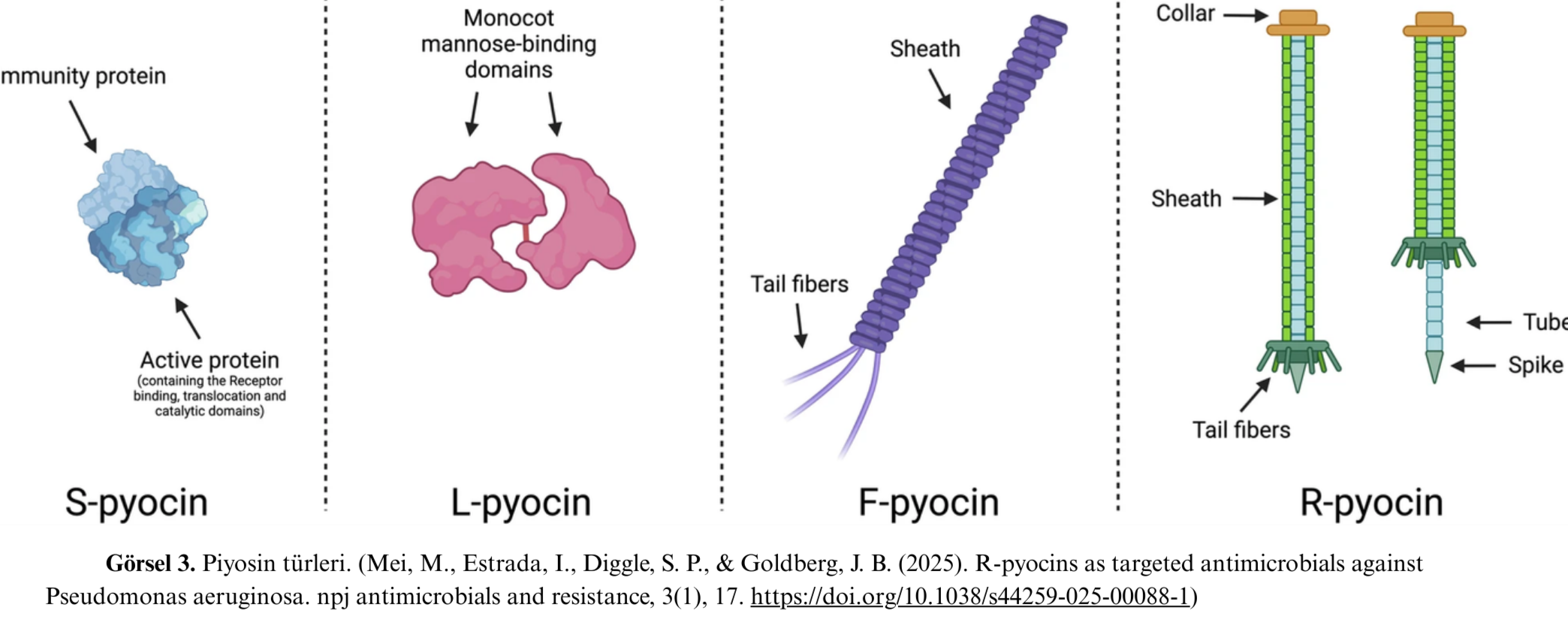
S-piyosinler, üretildiği suşlarda onlara eşlik eden bir bağışıklık proteini bulunduran tekil proteinlerdir; S-piyosinler, aktif olduklarında bir reseptör bağlayıcı bölge, translokasyon (geçiş) bölgeleri ve DNAaz aktivitesi gibi bir katalitik bölge içerir [25]. S-piyosinlerin aksine, R-piyosinler ve F-piyosinler, DNA içeren kapsid başlıkları olmayan faj kuyruklarına benzer yapıdadır [30]. L-piyosinler ya da lektin-benzeri piyosinler ise ardışık olarak düzenlenmiş iki monokot mannoz bağlayıcı lektin (MMBL) bölgesinden oluşan dar spektrumlu antibakteriyel proteinlerdir ve esas olarak bitkilerle ilişkili Pseudomonas türlerinde bulunurlar [31]. F-piyosinler, filamentöz, kasılmayan bir bakteriyofajı andıran esnek bir yapıya sahiptir ve eskiden Siphoviridae familyasına ait olan fajlara benzerlik gösterirler. F-piyosinlerin öldürme spektrumlarına göre tanımlanmış altı alt tipi (veya dizilerine göre farklılık gösteren 11 alt tip) tanımlanmıştır. Ancak, etki mekanizmaları hakkında çok az şey bilinmektedir; bilinen sınırlı bilgiye göre, lipopolisakkaritlere (LPS) bağlandıkları, zar boyunca bir kanal oluşturdukları ve solunumu bozdukları düşünülmektedir [32-34]. R-piyosinler- P. aeruginosa‘nın kasılabilir, faj kuyruğu benzeri bakteriyosinleri- güçlü anti-pseudomonal etkileri, bilinen reseptörleri ve iyi tanımlanmış etki mekanizmaları nedeniyle alternatif antimikrobiyal tedavilerin geliştirilmesinde özellikle ilgi çekmektedir.
R-piyosin
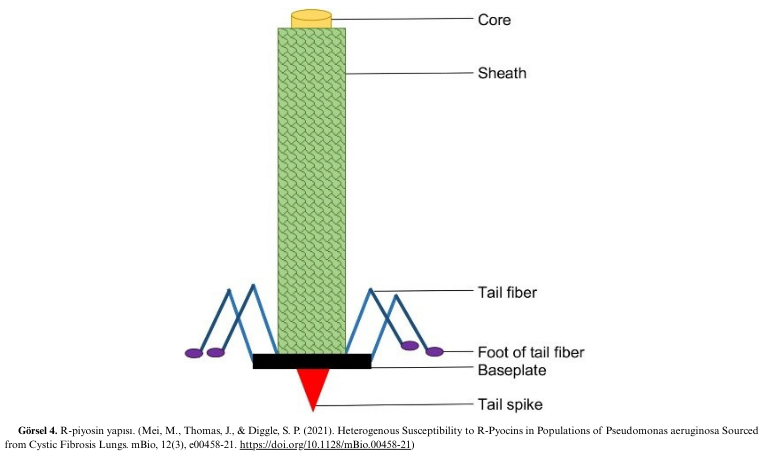
1964 yılında Kageyama ve arkadaşları, ilk R-piyosinleri Myoviridae ailesine ait bakteriyofajların esnek olmayan, kasılabilir kuyruk yapılarına benzeyen yüksek moleküler ağırlıklı proteinler olarak tanımlamıştır. Özellikle, R-piyosinler; rijit bir çekirdek, kılıf, taban plakası (baseplate) ve kuyruk liflerinden oluşan, 120 nm uzunluğunda ve 15 nm genişliğinde çift katmanlı içi boş silindirik yapılardır. Çekirdek, kasılabilir bir dış kılıfla çevrilidir ve bu kılıf hem taban plakası hem de çekirdeğe bağlıdır. Kuyruk lifleri, piyosinlerin hedef hücreye bağlanmasından sorumludur. Kuyruk lif proteini olan Prf15’in amino asit diziliminin analizine göre, R-piyosinler R1, R2, R3, R4 ve R5 olmak üzere beş ana gruba ayrılmıştır. R2, R3 ve R4’ün Prf15 amino asit dizilimleri neredeyse aynıdır; buna karşın R1 ve R5, piyosin yapısının C-terminal bölgesinde farklılıklar gösterir. Farklı R-piyosinlerin etki mekanizmasında, hedef hücre zarına bağlandıktan sonra kılıf yapısı kasılır ve piyosin çekirdeği hücre zarfına yerleştirilir. Bu yapı, hücre zarında bir kanal oluşturarak membranı depolarize eder ve bu durum protein ile nükleik asit sentezinin durmasına neden olur [33,35,36].
F-piyosin
Faj kuyruğu benzeri bakteriyosinlerin ikinci türü F-piyosinlerdir. 1967 yılında Takeya ve arkadaşları, F-piyosinlerin yapısını esnek çubuk benzeri parçacıklar olarak tanımlamıştır; bu yapılar bir çekirdek, taban plakası ve birkaç kısa ve uzun filamandan oluşan kuyruk liflerini içerir. F-piyosin çubuk yapıları, R-piyosinlere göre daha kısadır; yaklaşık 106 nm uzunluğunda ve 10 nm genişliğindedir. Kuyruk liflerinin uzunluğu ise yaklaşık 50 nm olarak tahmin edilmektedir. Özellikle, F-piyosin çubuğunun bir ucu kare şeklinde başlar ve ince lifler oluşturarak yaklaşık 43 nm uzunluğa kadar daralır. Filamentler, F-piyosinlerin hedef hücrelere bağlanmasından sorumludur ve bu bağlanma, farklı kısa ve uzun filament kompozisyonları aracılığıyla değiştirilebilir [30,35,37].
S-piyosin
P. aeruginosa, kolisin benzeri çeşitli bakteriyosinler üretir ve bunlar S-piyosinler olarak bilinir. R- ve F-piyosinlerle karşılaştırıldığında, S-piyosinler suda çözünür, ısıya ve proteazlara duyarlı proteinlerdir. Günümüze kadar birçok S-piyosin alt tipi tanımlanmıştır. S-piyosinler, büyük ve küçük protein komplekslerinden oluşan basit yapılı bakteriyosinlerdir. Bu komplekslerden büyük protein, DNA’yı parçalayarak öldürücü etkiyi sağlar; küçük protein ise, bağışıklık (immünite) proteini olarak adlandırılır ve konak hücrenin antibakteriyel aktivitesine karşı koruma sağlar. Bu koruma, büyük proteinin C-terminali ile bağışıklık proteininin N-terminali arasındaki etkileşime bağlanır. Çoğu S-piyosinde, büyük protein N-terminalden C-terminale doğru sıralanmış dört bölgeden oluşur: Reseptör bağlayıcı bölge (I), Translokasyon bölgesi (II), Fonksiyonu bilinmeyen bölge (III) ve Öldürücü (katalitik) bölge (IV). Buna karşılık, S1 ve S5 piyosinleri sadece üç bölgeye sahiptir: reseptör bağlayıcı, translokasyon ve öldürücü bölgeler. S1 ve S2 piyosinlerinin C-terminal öldürücü bölgeleri yüksek oranda korunmuştur ve bu iki piyosin birbirine neredeyse tamamen benzerdir. Buna karşın, N-terminal reseptör bağlayıcı bölge S-piyosinler arasında daha az korunmuştur; bu da reseptör tanıma çeşitliliğini yansıtır. S-piyosinlerin moleküler ağırlıkları özellikle büyük protein bölgelerinde oldukça farklılık gösterir ve 32–84 kDa arasında değişir; buna karşılık, küçük bağışıklık proteinlerinin moleküler ağırlığı yaklaşık 10 kDa dır [3,35,38].
Piyosinlerin Antimikrobiyal Aktivitesine Yönelik Çalışmalar
Mohamed ve ark. (2021) çalışmalarında çeşitli klinik P. aeruginosa suşlarında elde edip saflaştırdıkları R-piyosin’in S. aureus, B. cereus, E. coli, L. monocytogenes, A. baumanii ve C. albicans türleri üzerine anti biyofilm etkinliğini saptamışlardır [39].
Charkhian ve ark. (2024) yaptıkları çalışmada S-piyosin’nin P. mirabilis, P. vulgaris, S. aureus, S. epidermidis, E. hirae, S. pyogenes, ve S. mutans üzerine antimikrobiyal aktivite gösterdiğini saptamışlardır. Ayrıca Mitomisin C’ nin P. aeruginosa’nın piyosin sekresyonu üzerinde indükleyici özellik gösterdiği sonucunu elde etmişlerdir [40].
Saha ve ark. (2023) araştırmalarında P. aeruginosa’dan elde edile F-piyosinlerin ilgi çekici şekilde başka klinik P. aeruginosa üzerine bakterisidal etkinliğini saptamışlardır. Bu etki, piyosinlerin hedef bakterilerin dış zarındaki lipopolisakkarit (LPS) yapılarıyla etkileşimine bağlı olduğu düşünülmektedir [34].
Smith ve ark. (2011), rekombinant S2-piyosinin P. aeruginosa üzerindeki etkilerini Galleria mellonella modeli üzerinde incelemiş ve P. aeruginosa ile enfekte edilen larvaların rekombinant S2-piyosin enjeksiyonu ile yaşam sürelerinin uzadığını dolayısıyla bu piyosinin potansiyele sahip olduğunu bildirmişlerdir [41].
Yine başka bir çalışmada Six ve ark. (2021) S5-piyosin ve AP41-piyosin’in etkilerini P. aeruginosa sepsisin mürin modelinde incelemiş enfeksiyondan 5 saat sonra uygulandığında hayatta kalma oranlarını %33’ten %83’e önemli ölçüde artırdığını saptamışlardır. AP41-piyosin de hayatta kalma oranını artırmış ancak S5’ten daha az etkili olmuştur. Her iki piyosin de tek başına enjekte edildiğinde bir bağışıklık tepkisine neden olmamıştır [42].
REFERANSLAR
- Lister, P. D., Wolter, D. J., & Hanson, N. D. (2009). Antibacterial-resistant Pseudomonas aeruginosa: clinical impact and complex regulation of chromosomally encoded resistance mechanisms. Clinical microbiology reviews, 22(4), 582–610. https://doi.org/10.1128/CMR.00040-09
- Tang, Y. W., Hindiyeh, M., Liu, D., Sails, A., Spearman, P., & Zhang, J. R. (Eds.). (2023). Molecular medical microbiology. Academic press.
- Michel-Briand, Y., & Baysse, C. (2002). The pyocins of Pseudomonas aeruginosa. Biochimie, 84(5-6), 499–510. https://doi.org/10.1016/s0300-9084(02)01422-0
- Moradali, M. F., Ghods, S., & Rehm, B. H. (2017). Pseudomonas aeruginosa Lifestyle: A Paradigm for Adaptation, Survival, and Persistence. Frontiers in cellular and infection microbiology, 7, 39. https://doi.org/10.3389/fcimb.2017.00039
- Stover, C. K., Pham, X. Q., Erwin, A. L., Mizoguchi, S. D., Warrener, P., Hickey, M. J., Brinkman, F. S., Hufnagle, W. O., Kowalik, D. J., Lagrou, M., Garber, R. L., Goltry, L., Tolentino, E., Westbrock-Wadman, S., Yuan, Y., Brody, L. L., Coulter, S. N., Folger, K. R., Kas, A., Larbig, K., … Olson, M. V. (2000). Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen. Nature, 406(6799), 959–964. https://doi.org/10.1038/35023079
- Kang, C. I., Kim, S. H., Kim, H. B., Park, S. W., Choe, Y. J., Oh, M. D., Kim, E. C., & Choe, K. W. (2003). Pseudomonas aeruginosa bacteremia: risk factors for mortality and influence of delayed receipt of effective antimicrobial therapy on clinical outcome. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America, 37(6), 745–751. https://doi.org/10.1086/377200
- Sader, H. S., Castanheira, M., Streit, J. M., & Flamm, R. K. (2019). Frequency of occurrence and antimicrobial susceptibility of bacteria isolated from patients hospitalized with bloodstream infections in United States medical centers (2015-2017). Diagnostic microbiology and infectious disease, 95(3), 114850. https://doi.org/10.1016/j.diagmicrobio.2019.06.002
- Peña, C., Cabot, G., Gómez-Zorrilla, S., Zamorano, L., Ocampo-Sosa, A., Murillas, J., Almirante, B., Pomar, V., Aguilar, M., Granados, A., Calbo, E., Rodríguez-Baño, J., Rodríguez-López, F., Tubau, F., Martínez-Martínez, L., Oliver, A., & Spanish Network for Research in Infectious Diseases (REIPI) (2015). Influence of virulence genotype and resistance profile in the mortality of Pseudomonas aeruginosa bloodstream infections. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America, 60(4), 539–548. https://doi.org/10.1093/cid/ciu866
- Thaden, J. T., Park, L. P., Maskarinec, S. A., Ruffin, F., Fowler, V. G., Jr, & van Duin, D. (2017). Results from a 13-Year Prospective Cohort Study Show Increased Mortality Associated with Bloodstream Infections Caused by Pseudomonas aeruginosa Compared to Other Bacteria. Antimicrobial agents and chemotherapy, 61(6), e02671-16. https://doi.org/10.1128/AAC.02671-16
- Antimicrobial Resistance Collaborators (2022). Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet (London, England), 399(10325), 629–655. https://doi.org/10.1016/S0140-6736(21)02724-0
- Rice L. B. (2008). Federal funding for the study of antimicrobial resistance in nosocomial pathogens: no ESKAPE. The Journal of infectious diseases, 197(8), 1079–1081. https://doi.org/10.1086/533452
- Tacconelli, E., Carrara, E., Savoldi, A., Harbarth, S., Mendelson, M., Monnet, D. L., Pulcini, C., Kahlmeter, G., Kluytmans, J., Carmeli, Y., Ouellette, M., Outterson, K., Patel, J., Cavaleri, M., Cox, E. M., Houchens, C. R., Grayson, M. L., Hansen, P., Singh, N., Theuretzbacher, U., … WHO Pathogens Priority List Working Group (2018). Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. The Lancet. Infectious diseases, 18(3), 318–327. https://doi.org/10.1016/S1473-3099(17)30753-3
- Behrens, H. M., Lowe, E. D., Gault, J., Housden, N. G., Kaminska, R., Weber, T. M., Thompson, C. M. A., Mislin, G. L. A., Schalk, I. J., Walker, D., Robinson, C. V., & Kleanthous, C. (2020). Pyocin S5 Import into Pseudomonas aeruginosa Reveals a Generic Mode of Bacteriocin Transport. mBio, 11(2), e03230-19. https://doi.org/10.1128/mBio.03230-19
- Melnikov, S. V., Stevens, D. L., Fu, X., Kwok, H. S., Zhang, J. T., Shen, Y., Sabina, J., Lee, K., Lee, H., & Söll, D. (2020). Exploiting evolutionary trade-offs for posttreatment management of drug-resistant populations. Proceedings of the National Academy of Sciences of the United States of America, 117(30), 17924–17931. https://doi.org/10.1073/pnas.2003132117
- Goel, N., Fatima, S. W., Kumar, S., Sinha, R., & Khare, S. K. (2021). Antimicrobial resistance in biofilms: Exploring marine actinobacteria as a potential source of antibiotics and biofilm inhibitors. Biotechnology reports (Amsterdam, Netherlands), 30, e00613. https://doi.org/10.1016/j.btre.2021.e00613
- García-Vela, S., Ben Said, L., Soltani, S., Guerbaa, R., Fernández-Fernández, R., Ben Yahia, H., Ben Slama, K., Torres, C., & Fliss, I. (2023). Targeting Enterococci with Antimicrobial Activity against Clostridium perfringens from Poultry. Antibiotics (Basel, Switzerland), 12(2), 231. https://doi.org/10.3390/antibiotics12020231
- Góchez, D., Raicek, M., Pinto Ferreira, J., Jeannin, M., Moulin, G., & Erlacher-Vindel, E. (2019). OIE Annual Report on Antimicrobial Agents Intended for Use in Animals: Methods Used. Frontiers in veterinary science, 6, 317. https://doi.org/10.3389/fvets.2019.00317
- Servin A. L. (2004). Antagonistic activities of lactobacilli and bifidobacteria against microbial pathogens. FEMS microbiology reviews, 28(4), 405–440. https://doi.org/10.1016/j.femsre.2004.01.003
- Olano, C., Lombó, F., Méndez, C., & Salas, J. A. (2008). Improving production of bioactive secondary metabolites in actinomycetes by metabolic engineering. Metabolic engineering, 10(5), 281–292. https://doi.org/10.1016/j.ymben.2008.07.001
- Bibb M. J. (2005). Regulation of secondary metabolism in streptomycetes. Current opinion in microbiology, 8(2), 208–215. https://doi.org/10.1016/j.mib.2005.02.016
- Shafipour Yordshahi, A., Moradi, M., Tajik, H., & Molaei, R. (2020). Design and preparation of antimicrobial meat wrapping nanopaper with bacterial cellulose and postbiotics of lactic acid bacteria. International journal of food microbiology, 321, 108561. https://doi.org/10.1016/j.ijfoodmicro.2020.108561
- Foudjing, G. G. D., Sarmast, E., Allahdad, Z., Salmieri, S., & Lacroix, M. (2023). Influence of growth parameters on bacteriocin-like inhibitory substances (BLIS) production by lactic acid bacteria. Letters in applied microbiology, 76(1), ovac013. https://doi.org/10.1093/lambio/ovac013
- Atanaskovic, I., Sharp, C., Press, C., Kaminska, R., & Kleanthous, C. (2022). Bacterial Competition Systems Share a Domain Required for Inner Membrane Transport of the Bacteriocin Pyocin G from Pseudomonas aeruginosa. mBio, 13(2), e0339621. https://doi.org/10.1128/mbio.03396-21
- Doshi, M. N., Nair, K., Hassan, Z. U., & Jaoua, S. (2022). Pyocin QDD1: a highly thermostable bacteriocin produced by Pseudomonas aeruginosa QDD1 for the biocontrol of foodborne pathogens Staphylococcus aureus and Bacillus cereus. Bioresource Technology Reports, 18, 101106.
- Oluyombo, O., Penfold, C. N., & Diggle, S. P. (2019). Competition in Biofilms between Cystic Fibrosis Isolates of Pseudomonas aeruginosa Is Shaped by R-Pyocins. mBio, 10(1), e01828-18. https://doi.org/10.1128/mBio.01828-18
- Hays, E. E. et al. Antibiotic substances produced by Pseudomonas aeruginosa. Biol. Chem.159, 725–750 (1945).
- Jacob, F. Induced biosynthesis and mode of action of a pyocine, an antibiotic obtained from Ps. pyocyanea. Ann. Inst. Pasteur86, 149–160 (1954).
- Hugh, R. & Lessel, E. F. Pseudomonas aeruginosa or Pseudomonas pyocyanea? Int. J. Syst. Evol. Microbiol.17, 43–51 (1967)
- Mei, M., Estrada, I., Diggle, S. P., & Goldberg, J. B. (2025). R-pyocins as targeted antimicrobials against Pseudomonas aeruginosa. npj antimicrobials and resistance, 3(1), 17. https://doi.org/10.1038/s44259-025-00088-1
- Kuroda, K., & Kageyama, M. (1981). Comparative study of F-type pyocins of Pseudomonas aeruginosa. Journal of biochemistry, 89(6), 1721–1736. https://doi.org/10.1093/oxfordjournals.jbchem.a133372
- Ghequire, M. G., Dingemans, J., Pirnay, J. P., De Vos, D., Cornelis, P., & De Mot, R. (2014). O serotype-independent susceptibility of Pseudomonas aeruginosa to lectin-like pyocins. MicrobiologyOpen, 3(6), 875–884. https://doi.org/10.1002/mbo3.210
- Kuroda, K., & Kagiyama, R. (1983). Biochemical relationship among three F-type pyocins, pyocin F1, F2, and F3, and phage KF1. Journal of biochemistry, 94(5), 1429–1441.
- Nakayama, K., Takashima, K., Ishihara, H., Shinomiya, T., Kageyama, M., Kanaya, S., Ohnishi, M., Murata, T., Mori, H., & Hayashi, T. (2000). The R-type pyocin of Pseudomonas aeruginosa is related to P2 phage, and the F-type is related to lambda phage. Molecular microbiology, 38(2), 213–231. https://doi.org/10.1046/j.1365-2958.2000.02135.x
- Saha, S., Ojobor, C. D., Li, A. S. C., Mackinnon, E., North, O. I., Bondy-Denomy, J., Lam, J. S., Ensminger, A. W., Maxwell, K. L., & Davidson, A. R. (2023). F-Type Pyocins Are Diverse Noncontractile Phage Tail-Like Weapons for Killing Pseudomonas aeruginosa. Journal of bacteriology, 205(6), e0002923. https://doi.org/10.1128/jb.00029-23
- Ghequire, M. G., & De Mot, R. (2014). Ribosomally encoded antibacterial proteins and peptides from Pseudomonas. FEMS microbiology reviews, 38(4), 523–568. https://doi.org/10.1111/1574-6976.12079
- Williams, S. R., Gebhart, D., Martin, D. W., & Scholl, D. (2008). Retargeting R-type pyocins to generate novel bactericidal protein complexes. Applied and environmental microbiology, 74(12), 3868–3876. https://doi.org/10.1128/AEM.00141-08
- Takeya, K., Minamishima, Y., Amako, K., & Ohnishi, Y. (1967). A small rod-shaped pyocin. Virology, 31(1), 166–168. https://doi.org/10.1016/0042-6822(67)90021-9
- Sano, Y., Matsui, H., Kobayashi, M., & Kageyama, M. (1993). Molecular structures and functions of pyocins S1 and S2 in Pseudomonas aeruginosa. Journal of bacteriology, 175(10), 2907–2916. https://doi.org/10.1128/jb.175.10.2907-2916.1993
- Mohamed, A. A., Elshawadfy, A. M., Amin, G., & Askora, A. (2021). Characterization of R-pyocin activity against Gram-positive pathogens for the first time with special focus on Staphylococcus aureus. Journal of applied microbiology, 131(6), 2780–2792. https://doi.org/10.1111/jam.15134
- Charkhian, H., Soleimannezhadbari, E., Bodaqlouei, A., Lotfollahi, L., Lotfi, H., Yousefi, N., Shojadel, E., & Gholinejad, Z. (2024). Assessment of bacteriocin production by clinical Pseudomonas aeruginosa isolates and their potential as therapeutic agents. Microbial cell factories, 23(1), 175. https://doi.org/10.1186/s12934-024-02450-w
- Smith, K., Martin, L., Rinaldi, A., Rajendran, R., Ramage, G., & Walker, D. (2012). Activity of pyocin S2 against Pseudomonas aeruginosa biofilms. Antimicrobial agents and chemotherapy, 56(3), 1599–1601. https://doi.org/10.1128/AAC.05714-11
- Six, A., Mosbahi, K., Barge, M., Kleanthous, C., Evans, T., & Walker, D. (2021). Pyocin efficacy in a murine model of Pseudomonas aeruginosa sepsis. The Journal of antimicrobial chemotherapy, 76(9), 2317–2324. https://doi.org/10.1093/jac/dkab199